糖尿病
# 糖尿病
糖尿病 Diabetes mellitus (DM)
- 由遗传和环境因素共同引起的一组以糖代谢紊乱为主要表现的临床综合症。
- 胰岛素缺乏和胰岛素作用障碍单独或同时引起糖类、脂肪、蛋白质、水、电解质等的代谢紊乱,临床以慢性高血糖为主要特征,其急性并发症有糖尿病酮症酸中毒(DKA)、高渗性高血糖综合征和乳酸酸中毒。(上课说重点)
# 糖尿病分型
- 1型糖尿病:是由于胰岛b细胞破坏和胰岛素绝对缺乏引起的糖尿病,但不包括已阐明病因的b细胞破坏所致糖尿病。分为
- A.免疫介导性;
- B.特发性idopathic(缺乏免疫标记,美国黑人多见)。
- 2型糖尿病:是指从胰岛素抵抗为主伴胰岛素相对不足到胰岛素分泌不足为主伴胰岛素抵抗的糖尿病。
- 特殊类型糖尿病:包括胰岛b细胞功能基因突变性糖尿病(如青年发病的成年糖尿病MODY)或胰岛素受体基因突变性糖尿病等。
- 妊娠糖尿病。Gestational diabetes mellitus (GDM):不包括糖尿病合并妊娠。
成人晚发性自身免疫性糖尿病 latent autoimmune diabetes in adults,LADA
- 属于1型糖尿病的自身免疫型缓发型,为免疫破坏胰岛β细胞引起的胰岛素缺乏性糖尿病。
- 起病又具有隐匿、迟发(年后发病),消瘦的特点,发病初期口服降糖药治疗有效,无需使用胰岛素,这点与2型糖尿病相符合。
# 糖尿病病因(抗体标记是重点)
- 1型糖尿病
- 遗传
- 环境
- 自身免疫因素:体液免疫和细胞免疫
- 体液免疫(以下几个抗体记必须记住)
- 约90%的1型糖尿病患者有如下多种抗胰岛β细胞自身抗体
- Islet cell autoantibody(ICA)胰岛细胞自身抗体(分ICCA和ICSA)
- insulin autoantibodies(IAA)胰岛素自身抗体
- glutamic acid decarboxylase antibody(GADA)谷氨酸脱羧酶自身抗体
- autoantibody totyrosine phosphatasesIA-2和IA-2b酪氨酸磷酸酶自身抗体
- 2型糖尿病:
- 遗传因素在2型糖尿病的病史中较1型糖尿病明显。

# 病理生理过程

# 临床表现
- 1型糖尿病
- 青少年多见,起病急,三多一少(消瘦)较明显,儿童和青少年以糖尿病酮症酸中毒为首发表现,中后期糖尿病有常有慢性并发症。
- 2型糖尿病
- 中老年多见,起病缓,除三多一少外,还有皮肤瘙痒、女性外阴部瘙痒及高渗性高血糖等为首发症状。体重多肥胖,其他还可都有全身各大系统的症状,心血管,消化,泌尿,精神等。

| 1型 | 2型 | |
|---|---|---|
| 起病年龄 | 多<25y | 多>40y |
| 起病方式 | 起病急 | 缓慢而隐匿 |
| 起病时体重 | 多正常或消瘦 | 多超重或肥胖 |
| 三多一少症状 | 常典型 | 不典型,或无症状 |
| 急性并发症 | 易发生酮症酸中毒 | 易发生高渗高血糖状态 |
| 慢性并发症 | ||
| 肾病 | 30%~40%,主要死因 | 20% |
| 心血管病 | 较少 | 70%,主要死因 |
| 脑血管病 | 较少 | 较多 |
| 胰岛素及C肽释放试验 | 低下或缺乏 | 峰值延迟或不足 |
| 胰岛素治疗及反应 | 依赖外源性胰岛素生存,敏感 | 不依赖,抵抗 |
# 糖尿病急性并发症
# 糖尿病酮症酸中毒
糖尿病酮症酸中毒diabetic ketoacidosis DKA
由于胰岛素不足和升糖激素不适当升高引起的糖、脂肪和蛋白代谢严重紊乱综合症,以至于水、电解质和酸碱平衡失调,临床以高血糖、高血酮和代谢性酸中毒为主要表现。

糖尿病酮症酸中毒的生化改变?作用机制?
胰岛素缺乏时,伴随着胰高血糖素等升糖激素的不适当升高,葡萄糖对胰高血糖素分泌的抑制能力丧失,胰高血糖素对刺激(精氨酸和进食)的 反应增强,导致肝肾葡萄糖生成增多和外周组织利用葡萄糖障碍,加剧高血糖;并使肝脏的酮体生成旺盛,出现酮症或酮症酸中毒。酸中毒主要是由于脂肪动员和分解加速,大量游离脂肪酸在肝内经b-氧化为酮体,超过机体氧化能力而使血酮增高,尿酮增多,统称酮症。其他还有水电解质平衡紊乱。
# 高渗性高血糖综合征
高渗性高血糖状态hyperosmolar hyperglycemic state,HHS
DM的严重急性并发症,以严重高血糖而无明显酮症酸中毒、血浆渗透压升高,失水,意识障碍为特征。
糖尿病非酮症性高渗性昏迷的药物诱因:口服噻嗪类利尿剂、糖皮质激素。
| DM并发症 | 要点 | |
|---|---|---|
| 慢性 | 大血管病变 | 粥化,主、冠、脑、肾为主 |
| 微血管病变 | DN 视网膜:(非)增殖型 | |
| 神经病变 | 各种均有 | |
| 糖尿病足 | 感染、溃疡→骨质破坏和畸形 | |
| 急性 | DKA(烂苹果味) | 携氧障碍→酸中毒;严重脱水、电紊乱;MODS、CNS障碍 |
| NHDC(高渗…) | 严重高糖高渗→脱水→意识障碍\昏迷 | |
| 感染 | 皮肤、尿道、胆道、呼吸道等感染 |
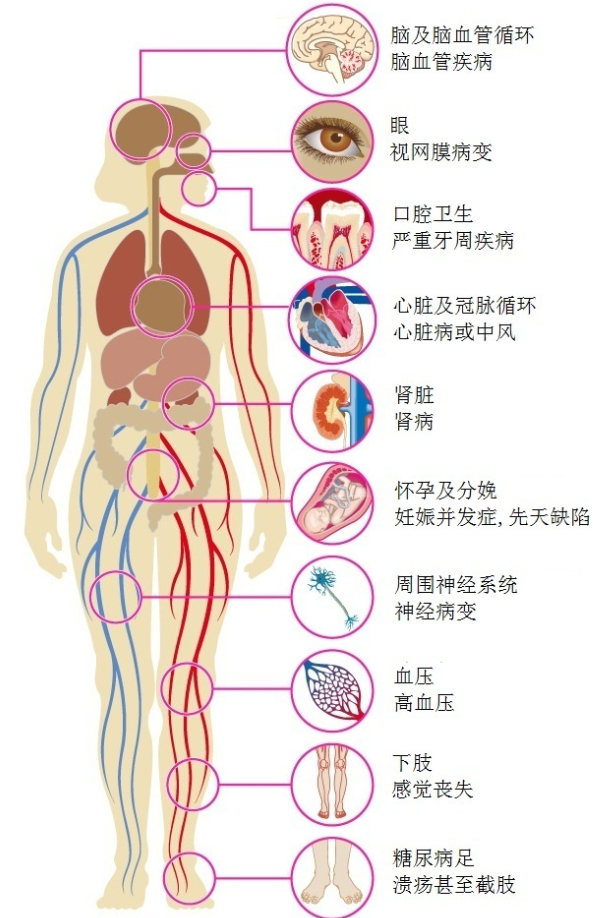
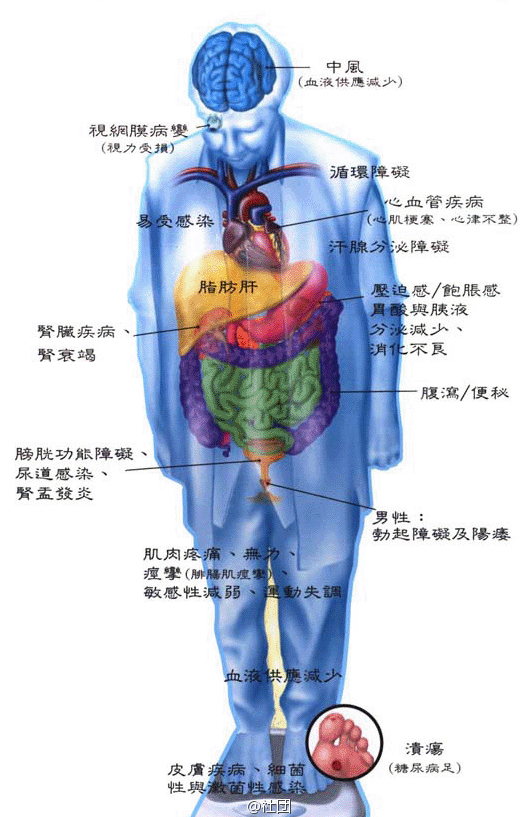
# 糖尿病(慢性)并发症
- 微血管病变:
- 糖尿病视网膜病(DRP),是最常见的微血管并发症和成年人后天性失明的主要原因(DRP分5期,新生血管是判断增殖期/非增殖期)。
- 病程超过10年的糖尿病患者常合并程度不等的视网膜病变,是失明的主要原因之一。
- 白内障、青光眼、屈光改变
- 糖尿病肾病:又称为肾小球硬化症,呈弥漫性或结节性肾小球硬化,结节性病变具有特异性,肾小球系膜区的嗜伊红结节(Kimmelstiel-Wilson结节)是诊断糖尿病肾病的可靠指标。(分5期,具体见后面)
- 心自主神经病变
- 糖尿病视网膜病(DRP),是最常见的微血管并发症和成年人后天性失明的主要原因(DRP分5期,新生血管是判断增殖期/非增殖期)。
- 大血管病变:
- 动脉粥样硬化的易患因素如肥胖、高血压、血脂异常等在糖尿病(主要是T2DM)人群中的发生率均明显增高
- 动脉粥样硬化,冠心病,周围血管病等
- 糖尿病神经病变
- 多发性神经病变
- 单一神经病变
- 糖尿病皮肤病变:糖尿病大疱病、糖尿病皮肤病
- 糖尿病合并感染
| 不同类型血管的病变 |
|---|
 |
| 从上到下不同部位症状 | 从上到下不同部位病变 |
|---|---|
 |  |
 |  |
# 糖尿病肾病
# 糖尿病肾病的临床分期
糖尿病肾病是T1DM的主要死因
- I 期:肾脏增大,GRF增加30%~40%,肾脏结构正常。
- 糖尿病初期,肾小球超滤过是此期最突出的特征,肾体积增大,肾小球人球小动脉扩张,肾血浆流量增加,肾小球内压增加,肾小球滤过率(GFR)明显升高;
- II 期:高滤过状态仍存在,运动后出现微量白蛋白尿。
- 肾小球毛细血管基底膜(GBM)增厚及系膜基质轻度增宽;尿白蛋白排泄率(UAER)多数正常,可间歇性增高(如运动后、应激状态),GFR轻度增高;
- III期:
- 早期糖尿病肾病期,GBM增厚及系膜基质增宽明显,小动脉壁出现玻璃样变;出现持续微量白蛋白尿,UAER持续在20~200μg/min(正常<10μg/min),GFR仍高于正常或正常;
- 持续性微量白蛋白尿
- 尿白蛋白/肌酐30-300mg/g,
- 或尿白蛋白排泄率20-200ug/min,
- 或尿白蛋白排泄量30~300mg/24h
- 常规尿化验蛋白 ➖ 阴性 。
- IV期:常规尿蛋白化验 ➕ 阳性,24小时蛋白排泄率>0.5g.(此期最关键)
- 临床糖尿病肾病期,肾小球病变更重,部分肾小球硬化,灶状肾小管菱缩及间质纤维化;尿蛋白逐渐增多,UAER>200μg/min,相当于尿蛋白总量>0.5g/24h;GFR下降;可伴有水肿和高血压,肾功能逐渐减退;部分患者可表现为肾病综合征;
- V 期:终末期糖尿病肾病,出现尿毒症临床表现。
- 尿毒症,多数肾单位闭锁;UAER降低,血肌酐升高,血压升高。ADA(2012) 推荐筛查和诊断微量白蛋白尿采用测定即时尿标本的白蛋白/肌酐比率,<30μg/mg,30~299μg/mg和≥300μg/mg分别定义为正常、微量白蛋白尿和大量白蛋白尿。

# 实验室检查(重点)
- 正常人肾糖阈 180mg/dl。
- 血糖升高是诊断糖尿病的依据,也是评价疗效的主要指标。
- 糖化血红蛋白A1c(HbA1c)测定在总血红蛋白中所占的比例能反映取血前8-12周的平均血糖水平,与点值血糖相互补充,作为血糖控制的检测指标,并已成为判断糖尿病控制的金标准。
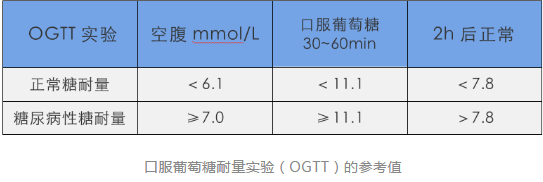
- 口服葡萄糖耐量试验(OGTT):取空腹血标本后,受试者饮用含有75g葡萄糖粉(或含1个水分子的葡萄糖82.5g)的液体250~300ml,5分钟内饮完,在口服后2小时采血测定血浆葡萄糖。
- 静脉注射葡萄糖耐量试验只适用于胃切除后,胃空肠吻合术后即吸收不良患者。
# 糖尿病的诊断标准
糖尿病诊断是基于空腹( FPG)、任意时间或OGTT中2小时血糖值(2h PG)
糖尿病症状 ➕ 随机血糖≥11.1mmol/L(200mg/dl);(典型症状三多一少)
空腹指至少8小时内无任何热量摄人
- FPG 3. 9 ~ 6.1mmol/L( 70 ~ 108mg/dl)为正常
- FPG,6.1 ~ 6.9mmol/L( 110 ~ 125mg/dl)为IFG(空腹血糖调节受损)
- 空腹血糖≥7.0mmol/L( 126mg/dl)应考虑糖尿病
OGTT2h PG
- < 7.8mmol/L( 139mg/dl)为正常糖耐量;
- OGTT2h,7.8 ~ 11. 0mmol/L( 140>199mg/dl)为IGT(糖耐量减低),
- 75g葡萄糖负荷后2小时血糖≥11.1mmol/L( 200mg/ dl) 应考虑糖尿病。
(无糖尿病症状者须另日重复测定血糖明确诊断。)
# 糖尿病治疗
- 内分泌科治疗目标
| 评估指标 | 目标结果 | |
|---|---|---|
| 血糖(mmol/L) | 空腹 | 4.4~6.1 |
| 非空腹 | 4.4~8.0 | |
| HbA1c(%) | < 6.5 | |
| 血压 | < 130/80mmHg | |
| TC(mmol/L) | < 4.5 | |
| 尿白蛋白排泄率 | < 20ug/min | |
总的来讲
(1)纠正代谢紊乱,消除糖尿病症状,维持良好的营养状况及正常的生活质量与工作能力,保障儿童的正常生长发育
(2)防止发生糖尿病急性代谢紊乱
(3)预防和延缓慢性并发症的发生发展。早期治疗,长期治疗,综合治疗和个体化治疗。
糖尿病教育
饮食治疗
- 糖类摄入量应占50%-60%,脂肪20-30%(相比正常人要减少)
运动疗法
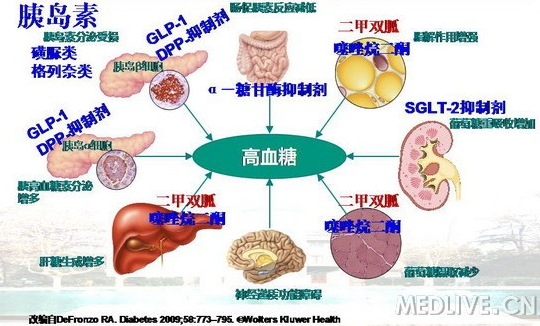
口服降糖药治疗(刺激胰岛素分泌,主要用于2型糖尿病,注意防止低血糖,6类机制)
①磺脲类Sulfonylureas:促进胰岛素分泌 (口服降糖药)
②双胍类biguanides:增加对糖的敏感性,主要在肝起作用,有减轻体重作用。
③噻唑烷二酮类thiazolidinediones:增加周围组织对胰岛素的敏感性。
④葡萄糖苷酶抑制剂glucosidase inhibitor:主要抑制葡萄糖吸收
⑤非SU促胰岛素分泌剂:如那格列奈nateglinide
⑥其他口服降糖药:胰岛素样肽-1(GLP-1),促进胰岛素分泌。
种类 作用 常用 SU 促泌剂 格列美脲 非SU 促泌剂 瑞格列奈 双胍 提高Glu利用,抑异生 二甲双胍 葡苷抑 延缓Glu吸收,降餐后 阿卡波糖 噻唑烷二酮 增敏剂 罗格列酮
二甲双胍副作用

- 胰岛素治疗
- 适应症 - 所有1型糖尿病和妊娠糖尿病应接受胰岛素治疗,其中1型要求终生治疗。 - 2型糖尿病发生下列情况时需要胰岛素治疗: - 高渗性高血糖、乳酸酸中毒、糖尿病酮症酸中毒 - 血糖控制不良的增殖型视网膜病 - 神经病变导致严重腹泻与吸收不良综合症 - 合并要种的感染、创伤、手术、急性心肌梗死及脑血管意外等应激 - 妊娠及哺乳期 - 肝肾功能不全和重症糖尿病肾病 - 显著消瘦及某些新诊断的2型糖尿病 - 同时有需要用糖皮质激素治疗的疾病 - 对口服降糖药耐药 - 某些特异性糖尿病如坏死性胰腺炎。
- 合并肾功能不全是胰-肾联合移植的适应证
# 胰岛素治疗的不良反应
主要低血糖 glycopenia;HG;hypoglycaemia
somogyi现象(低血糖后高血糖):应用胰岛素治疗的严重糖尿病病人,容易在午夜发生中度低血糖,而后对抗胰岛素激素增加,如肾上腺素、生长激素、糖皮质激素、胰高糖素等,使血糖上升。

# 凌晨高血糖胰岛素用量如何调节
对于空腹血糖高的患者,要区分空腹血糖高究竟是“苏木吉反应”还是“黎明现象”?
睡前用了中效胰岛素,而清晨血糖>8.0mmol/L,可测一次凌晨3点血糖,若≥4.0mmol/L,则称「黎明现象」,表明胰岛素不足,需增加用量。若<4.0mmoI/L,称「苏木杰效应」,表明胰岛素过量,应减少用量。
# 围术期血糖管理
围手术期高血糖: 指患者住院期间任意时点的血浆葡萄糖水平>7.8 mmol/L
行骨科手术时,推荐筛查糖化血红蛋白(HbA1c)。HbA1c≧6.5%可诊断为糖尿病,HbA1c﹤6.5%合并血糖升高者,提示存在应激性高血糖。
# 围手术期血糖控制标准
血糖控制不良指空腹血糖 > 7.8 mmol/L,或随机 血糖 > 10 mmol/L。
血糖控制良好指平均空腹血糖 ≤ 7.8 mmol/L,或随机血糖 ≤ 10 mmol/L。
围手术期各手术血糖控制目标分层:宽松控制、一般控制、严格控制
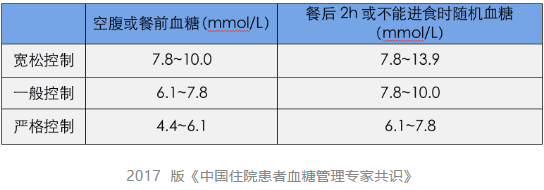
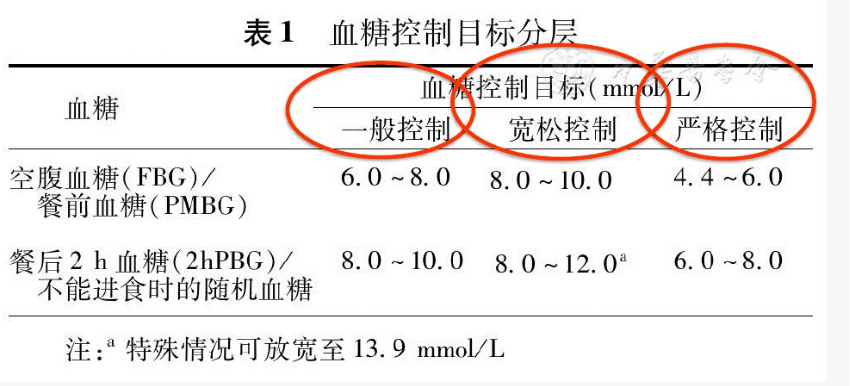
2017 版《中国住院患者血糖管理专家共识》
哪些人群,哪些手术需达到哪层管理水平呢?

# 术前管理
血糖控制
- 择期手术
- 空腹<7.8
- 餐后<10
- 急诊手术
- HbA1c>9%,随机血糖≥13.9,应推迟手术时间,加强血糖控制至血糖<11.1mmol/L
# 术后管理
恢复饮食,皮下注射胰岛素
- 控制血糖在正常范围
- 空腹血糖和餐前血糖<7.8
- 餐后血糖和随机血糖<10
# 血糖谱监测
# 平时胰岛素调整
# 原则:
- 根据凌晨空腹血糖调整长效胰岛素
- 由于血糖不能达标或出现低血糖,此时的胰岛素用量应根据空腹血糖调节
- 如果空腹血糖已调节在5.0~7.0mol/L时,可不增不减;
- 如果空腹血糖在3.0~5.0mmol/L时,胰岛素应减少2~3单位或改在餐后注射;
- 如果空腹血糖>7.0mmol/L,每增高1.4mmol/L加胰岛素1单位。
- 根据餐后-餐前血糖调整短效胰岛素
- 餐后2小时血糖高于10.0mmol/L后,每增高2.0mmol/L加胰岛素1单位,但一次加量不超过4单位。
- 酮症酸中毒静脉用胰岛素时,血糖下降的速度每小时不可超过5.6mmol/L,否则易引发脑水肿。
- 一般情况下,每次调整增量2U
# 术前临时增加较多胰岛素的禁忌评估
- 不要有急性电解质代谢紊乱
- 肝肾功能好
- 无酮症
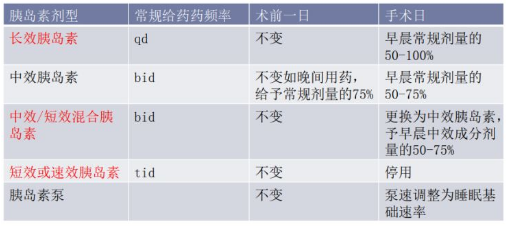
# 术前和手术日胰岛素调整
入院前已使用胰岛素者,根据胰岛素具体种类调整使用方案。
具体调整方案
# 其他补充概念
IFG空腹葡萄糖受损impaired fasting glucose
FPG ≥6.1 mmol/L (100 mg/dL) but ≤7.0 mmol/L (126 mg/dL)(即空腹血糖6.1~7.0mmol/L)
IGT葡萄糖耐量减退 impaired glucose tolerance
plasma glucose levels between 7.8 and 11.1 mmol/L (140 and 200 mg/dL) 2 h after a 75-g oral glucose load(即OGTT2小时血浆葡萄糖7.8~11.1mmol/L)
代谢综合症metabolic syndrome
遗传背景和不利环境因素使机体发生胰岛素抵抗及代偿性高胰岛素血症,并发高血压、脂质代谢紊乱、糖代谢紊乱、高纤维蛋白原血症及白蛋白尿症等,共同构成大血管的并发症。肥胖是导致胰岛素抵抗的关键因素。
黄脲类SU药物作用机制
主要是刺激胰岛β细胞分泌胰岛素,SU与胰岛b细胞表面的特异受体SUR结合,抑制细胞膜ATP敏感性K+离子通道,使之关闭,随着细胞内K+浓度升高,膜去极化,Ca2+通道开放,b细胞内Ca升高,刺激胰岛素分泌。SU还抑制磷酸二酯酶活性,升高细胞内cAMP,使b细胞内Ca进一步升高。